С.Семиков "Лёд и пламень"

ЛЁД И ПЛАМЕНЬ
(напечатано в журнале "Инженер" №2, 2005 г.)
"Там же, - продолжает подшучивать Свифт, - я увидел другого учёного, занимавшегося пережиганием льда в порох. Он показал мне написанное им исследование о ковкости пламени, которое он собирается опубликовать". Теперь видно всем, что шутить надо было осторожнее. Лёд сегодня пережжён в порох. Это сделали люди, с которыми шутки плохи. Мы имеем в виду создателей водородной бомбы. Ядра атомов дейтерия, содержащегося в воде, слились в ядра гелия, образуя термоядерную реакцию в виде грандиозного взрыва.

Этот фрагмент из "Трактата о вдохновенье, рождающем великие изобретения" В. Орлова (М., 1964) ещё раз подтверждает, что самые невероятные и смелые проекты, даже взятые из шутливого свифтовского описания Гулливером Академии прожектёров, могут со временем стать реальностью. Более того, возможно, именно в них кроется выход из наиболее острого и неумолимо надвигающегося кризиса - топливно-энергетического. Ведь теперь из воды и впрямь научились добывать не только горючее (кислород + водород), на котором работают некоторые ракеты и автомобили, но, как верно заметил Орлов, и энергию.
Пока эта термоядерная энергия приручается с трудом, эффективно выделяясь лишь в процессе неуправляемого взрыва. Но к осуществлению управляемой термоядерной реакции синтеза (слияния) ядер дейтерия наука неумолимо приближается и при том с разных сторон, всё теснее сжимая кольцо окружения. Совершенствуются магнитные ловушки для плазмы (недавно одну из них запустили
во Франции), лазерные ядерные установки, возлагаются даже надежды на таинственный холодный ядерный синтез (см. "Инженер" №6, 2005 г).
Так что со временем будет обуздана и эта непокорная энергия будущего. "Будущего", поскольку энергия синтеза, в отличие от энергии ядерного распада или химического горения, - одна из самых чистых и безвредных для экологии. Но главное, запасы этой энергии практически неисчерпаемы и вседоступны: термоядерное топливо (дейтерий) можно получать прямо из воды. Причём, как показывает любопытный расчёт из книги И. Петрянова [1], из одного литра простой воды можно добыть столько же энергии, сколько из 120 кг высококачественного угля. Вот и представьте, какие неимоверные запасы энергии таит Мировой океан!
Не менее важно и то, что вода имеется всюду. Значит, не нужна будет разведка месторождений нефти, угля и газа, не будет причин для топливных войн, развязыванием которых ознаменовалось начало нового тысячелетия. Какой может быть спор, когда энергия - вот она: подходи и черпай её хоть ведром. Впрочем, не всё так просто, ведь из воды предстоит ещё извлечь дейтерий. Этот тяжёлый изотоп водорода (обозначаемый "D") содержится в воде в форме соединения D2O, называемого тяжёлой водой (благодаря дейтерию она в 1,1 раза тяжелее простой воды H2O). Так что следующей после проблемы управляемого термоядерного синтеза предстоит решить задачу о добыче тяжёлой воды.
В принципе, эта задача уже решена, и тяжёлую воду сейчас могут получать в сравнительно больших количествах. Однако процесс её выделения сложен и дорог, да и получают тяжёлую воду, как правило, не из воды, а из других веществ, содержащих дейтерий. Ведь в тонне простой воды всего около 150 г воды тяжёлой. D2O можно отделить от H2O, используя разницу их физических и химических свойств. Так, если H2O кипит при 100 °C, то D2O - только при 101,4 °C. Разница почти незаметна и потому нужны сотни последовательных дистилляций, прежде чем из воды удастся выделить достаточно чистую тяжёлую воду. Именно так - многоступенчатой дистилляцией (правда, обычно дистиллируют не саму воду, а водород), электролизом и другими многократными операциями и удаётся получить дейтерий. Соответственно процесс выходит весьма дорогостоящим и долгим. А потому очень пригодились бы более совершенные и экономичные способы добычи D2O из воды.
В связи с этим кажется интересным предположение о том, что и в природе на протяжении миллионов лет может происходить постепенное естественное выделение и накопление тяжёлой воды в неких неизвестных водоёмах. Ведь год за годом природа делает не что иное, как многократную передистилляцию. Вода испаряется с поверхности водоёмов, а потом конденсируется в виде дождя, отчего в водоёмах постепенно должна расти концентрация тяжёлой воды. На эту мысль наводит уже хотя бы тот факт, что содержание дейтерия в дождевой, речной и морской воде заметно разнится [2, с. 99]. И всё же существование озёр с тяжёлой водой под большим сомнением; миллионы лет накопления в них D2O шли бы насмарку из-за редких случайных затоплений их простой водой. Слишком легко смешиваются в водоёмах разные воды, чтобы стоило искать в них жидкую D2O.
Гораздо вероятней гипотеза географа М. Аджиева, по которой где-то могут существовать залежи замороженной тяжёлой воды - "тяжёлого льда" [3]. Тогда эффективным поставщиком термоядерного топлива и энергии стал бы, как у Свифта, именно лёд, а не просто вода. В самом деле, точки плавления D2O и H2O отстоят друг от друга гораздо дальше, чем точки их кипения. Если простая вода замерзает при 0 °C, то тяжёлая - лишь при +4 °C. Поэтому при многократной перекристаллизации отделение D2O должно идти более эффективно, чем при дистилляции. Учитывая же, что во многих местах Земли лёд и снег то тают, то вновь намерзают, в них и впрямь может протекать процесс естественного накопления тяжёлой воды. Не случайно во многих ледниках содержание дейтерия повышено по сравнению с нормой, хотя и ненамного. И раз уж тяжёлый лёд не в состоянии смешаться с простой водой, то намерзающие слой за слоем залежи тяжёлого льда и впрямь могли бы где-то сохраниться в виде мощных ледниковых пластов.
Впрочем, вполне вероятно, что выделение тяжёлой воды происходит не только где-то в укромных местах, но и у нас на виду. Многие, возможно, задумывались над удивительной способностью воды расширяться при замерзании. Но куда необычней другое её свойство: в отличие от всех прочих жидкостей вода достигает наивысшей плотности не в точке кристаллизации (0 °C), а при температуре +4 °C. То есть при нагревании в диапазоне от нуля до 4 °C вода не расширяется, как любая жидкость, а сжимается (см. график). И лишь перевалив за 4 °C, вода начинает при нагреве вести себя как все нормальные жидкости, то есть расширяется.
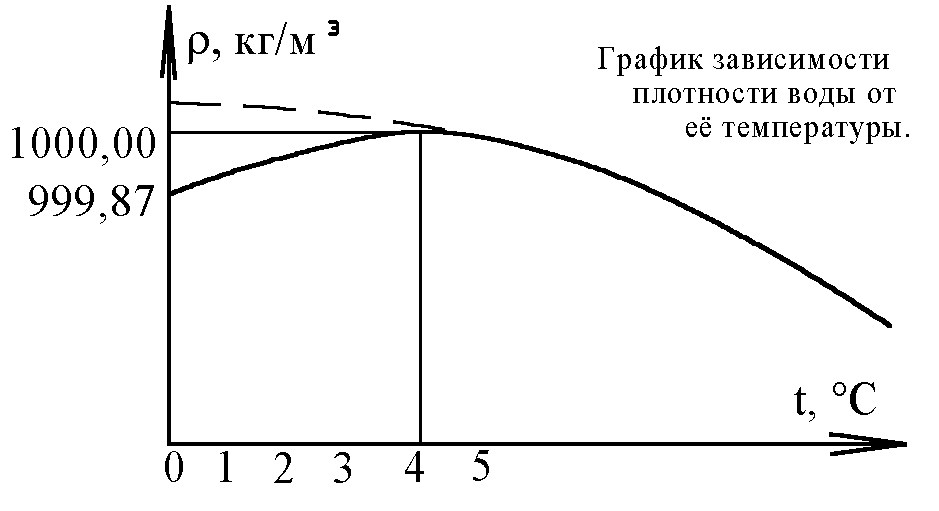
Полагают, что аномальное сжатие воды связано с тем, что даже в жидком состоянии она отчасти сохраняет молекулярную структуру льда, окончательно распадающуюся лишь при сильном нагреве. А поскольку лёд легче воды, то его структура делает воду менее плотной. С повышением температуры льдоподобная структура воды становится всё менее выраженной, вода переходит в истинно жидкое состояние, и плотность её нарастает, достигая максимума при 4 °C, после чего над процессом сжатия преобладает тепловое расширение.
Но до сих пор никто не объяснил, отчего вода в жидком состоянии сохраняет льдоподобную структуру. А ответ, возможно, прост: при нагреве выше нуля плавится в основном только простая вода H
2O, тогда как небольшое количество имеющейся в ней тяжёлой воды D2O остаётся в кристаллическом состоянии: температура её плавления равна тем самым 4 °C. Именно при этой температуре расплавится, наконец, и тяжёлая вода. И, следовательно, начиная только с этой температуры, вода будет расширяться. Поскольку молекулы D2O в воде слишком рассеяны, то они, вероятно, образуют гибридные кристаллы, содержащие в разных пропорциях D2O и H2O. Поэтому и температуру плавления все эти кристаллы имеют разную (в зависимости от соотношения изотопов), промежуточную между 0 и 4 °C. В этом интервале кристаллы постепенно плавятся: сперва легкоплавкие, затем всё более тугоплавкие, отчего плотность воды в этом интервале нарастает постепенно, а не скачком. Чистая же вода, не содержащая изотопов, должна, очевидно, показывать нормальный ход зависимости плотности от температуры, то есть всегда расширяться при нагреве (см. пунктир на графике).
Итак, даже в холодильнике при замораживании или размораживании воды должен протекать процесс выделения, фракционирования тяжёлой воды из её раствора в воде обыкновенной. Если б удалось как-то осадить кристаллики тяжёлой воды, выцедить их из раствора, или просто дождаться, пока они сольются в один крупный, то мы бы получили соединение сильно обогащённое D2O. И выделение чистой D2O стало бы обходиться намного дешевле.
Но не слишком ли мы увлеклись? Имеет ли в действительности место выделение тяжёлой воды возле точки кристаллизации? Согласуется ли это с научными данными? Имеются ли тому доказательства, помимо факта совпадения температуры плавления D2O и температуры наивысшей плотности H2O? Похоже, что да. С одной стороны уже никто не сомневается, что при таянии льда и замерзании воды происходит фракционирование изотопов, выделение тяжёлой воды из её раствора. С другой стороны, по мнению многих учёных, и в частности Г. Стюарта, холодная вода не просто обладает льдоподобной структурой, но содержит настоящие микрокристаллы льда, насчитывающие тысячи молекул и образующие как бы "снежные пятна, льдинки, плавающие в бассейне с водой" [2]. Рентгенографические исследования воды подтверждают эту точку зрения. Присутствие в воде таких льдинок нельзя объяснить, если только мы не предположим, что это и есть кристаллы тяжёлой воды.
Приведём и количественное подтверждение гипотезы. Плотность воды при 0 °C – 999,87 кг/м3, а при 4 °C – ровно 1000 кг/м3 (см. график). То есть тонна воды при 0 °C имеет объём на 0,13 литра больший, чем при 4 °C. Та же тонна воды, как известно, содержит 0,14 литра тяжёлой воды D2O, которая при замерзании увеличивается в объёме (как и лёд) на одну десятую, точнее на 0,013 литра, что хотя и меньше, но всё же сравнимо с наблюдаемым изменением объёма на 0,13 литра. Надо к тому же учесть, что кристаллы, как мы выяснили, могут быть гибридными, т.е. включать помимо молекул D2O ещё и молекулы H2O. Тогда суммарный объём кристаллов будет в несколько раз больше, чем 0,013 л.
Итак, ничто не запрещает тяжёлой воде выделяться из раствора в форме льда. Имеются к тому же и некоторые другие свидетельства, говорящие в пользу образования тяжеловодных кристаллов. Так, все слышали о лечебных свойствах талой воды. Многие, в том числе и упомянутый Аджиев, объясняют этот её эффект тем, что свежерастаявшая вода сохраняет в течение некоторого времени кристаллическую структуру льда, и тем, что при таянии в воде понижается содержание тяжёлой воды, вредной для организма (она остаётся вмороженной в лёд). И действительно, известно, что животворная вода горных ручьёв, берущих начало в тающих ледниках, обеднена тяжёлой водой (это прямое следствие большей тугоплавкости тяжёлой воды - она оттаивает в последнюю очередь). Такую обеднённую дейтерием горную воду именуют даже "живой водой" (тогда как обогащённую дейтерием - "мёртвой") [4]. Некоторые авторы именно её считают источником горного долгожительства.
Приведём в качестве свидетельства и такое редкое явление как донный, или внутриводный лёд, красочно описанное в рассказе Джека Лондона "На Сороковой миле". Явление состоит в том, что лёд начинает образовываться не, как обычно, на поверхности, где интенсивнее охлаждение, а температура близка к нулю, но по необъяснимым причинам возникает возле дна. У придонного же слоя воды не только мал отбор тепла, но и температура далека от точки замерзания: она равна тем самым +4 °C (на дно опускается вода с наибольшей плотностью). Причём образуется донный лёд не только зимой, когда на поверхности ещё нет никакого льда, но иногда даже и летом. Не удивительно, что рассказу джеклондоновского героя об этом явлении не поверили. И всё же явление реально существует, Наука его признаёт, вот только достоверно объяснить пока не может. Ну, в самом деле, как вода может замёрзнуть при 4 °C? Да если б и замёрзла, то лёд немедленно всплыл бы к поверхности!
Но всё легко объясняется, если, подобно Аджиеву, предположить, что донный лёд образован тяжёлой водой. Тяжёлая вода замерзает и интенсивней всего выделяется как раз при 4 °C. Более того, получающийся при этом тяжёлый лёд в отличие от простого льда имеет плотность почти такую же или даже чуть большую, чем у воды. Поэтому он не будет всплывать, если только на него не "намёрзнет" побольше "лёгких" молекул простой воды. Странно лишь то, что молекулы D2O способны образовывать крупные конгломераты в виде донного льда. Ведь, как мы выяснили, если D2O и выделяется из воды, то лишь в виде мельчайших кристалликов, имеющих поперечник в несколько десятков атомов, и потому не различимых ни глазом, ни с микроскопом. Но это верно лишь в отношении небольших объёмов воды.
В реке же условия несколько иные. Там над каждым участком дна в единицу времени протекает огромная масса воды, и из всего её объёма вымораживаются кристаллы тяжёлого льда. Имея плотность несколько большую, чем у воды, они длительно осаждаются на дно и смерзаются в относительно крупные кристаллические конгломераты. Видимо, именно поэтому донный, или внутриводный лёд слабо напоминает лёд обыкновенный: по описанию он больше похож на снег - это белая рыхлая масса из смёрзшихся кристаллов. Не зря донный лёд сравнивают по внешнему виду с кораллами. Проверить справедливость гипотезы можно было бы элементарным измерением плотности донного льда. Если она окажется заметно большей, чем у простого, то лёд этот, без сомнения, образован именно тяжёлой водой. Можно и непосредственно определить содержание дейтерия в донном льду.
Итак, если верна гипотеза Аджиева, то тяжёлую воду, выделяющуюся в природе в виде кристаллов, можно было бы получать в огромных количествах и при том почти бесплатно. Надо было бы лишь разведать, где донный лёд чаще всего возникает, или образует залежи. Возможно, стоит даже попробовать подтолкнуть, интенсифицировать этот природный процесс, создав на реках специальные станции по производству и добыче донного льда. По сути, это будет ещё один способ использования даровой энергии текущей воды, солнца и температурных колебаний, но, учитывая огромную "энергетическую ценность" тяжёлой воды, куда более эффективный, чем в ГЭСах, ветроэлектрогенераторах и гелиоустановках.
Впрочем, и в настоящее время, пока эффективная управляемая термоядерная реакция не осуществлена, возможность добычи тяжёлой воды изо льда может оказаться полезной и рентабельной. Ведь дешёвая тяжёлая вода пригодилась бы уже сейчас - в ней нуждаются и медицинские заведения, и исследовательские институты, и атомная энергетика. И именно в России, обладающей наибольшими среди всех стран запасами льда, максимальным числом ледников, студёных ручьёв и рек, следовало бы всерьёз задуматься о добыче из него тяжёлой воды. Кто знает, может в будущем окажется, что лёд и снег - это второе по важности природное богатство России (первым, как показывают замечательные книги В. Орлова, всегда была и останется русская изобретательность и смекалка). Тогда и придёт время перековать лёд на пламень.
Сергей Семиков
Постскриптум:
Может оказаться и так, что аномальное сжатие воды, донный лёд и прочие явления связаны с присутствием в воде отнюдь не D
2O, а совсем другой формы тяжёлой воды. Дело в том, что "тяжёлых вод" существует несколько, и одна из них, с формулой H218O, особенно примечательна. Это та же вода, но в ней замещены тяжёлыми изотопами уже не атомы водорода, но атомы кислорода (16O замещён 18O), поэтому такую воду называют тяжелокислородной. Молекулы H218O и D2O весят одинаково, и потому надо ожидать, что тяжёлая вода H218O имеет ту же плотность и температуру кристаллизации, что и D2O. Значит, все наши догадки относительно роли D2O в большей или меньшей степени применимы и к H218O. К тому же содержание H218O в воде намного больше, чем какой-либо из других тяжёлых вод: тонна простой воды в среднем содержит полтора литра H218O [1].
Так что, возможно, и аномальная зависимость плотности воды от температуры вызвана присутствием тяжелокислородной воды. Ведь содержащиеся в тонне воды полтора литра H218O расширяются при замерзании как раз на те самые 0,14 литра, равные приросту объёма тонны воды, охлаждаемой с 4 °C до нуля, которые полностью нельзя было объяснить, привлекая лишь D2O. Более того, изотоп 18O позволяет объяснить, почему сама тяжёлая вода D2O имеет наивысшую плотность уже не при 4 °C, а, как выяснили, при 11 °C. Вероятно, именно при этой температуре начинает плавиться сверхтяжёлое соединение D218O, играющее в D2O ту же роль, что сама тяжёлая вода играла, по нашей гипотезе, в обычной.
Наконец, по мнению многих, в воде почти нет молекул D2O, а дейтерий в неё входит в виде соединения HDO, где лишь один атом водорода замещён атомом дейтерия. Естественно, свойства этого вещества совсем иные, чем у D2O, в том числе другая температура плавления (наверное, где-то посредине между 0 и 4 °C). И может оказаться так, что микрокристаллы льда и донный лёд образованы в основном не D2O, а тяжелокислородной водой, в которой нет дейтерия. Так что энергетические надежды, возлагаемые на лёд, могут оказаться напрасными. Впрочем, и тогда огорчаться не стоило бы, поскольку H218O - это соединение ещё более дорогостоящее, дефицитное и нужное, чем D2O. Загадочную тяжелокислородную воду очень сложно выделить, а в более-менее чистом виде она вообще до сих пор не получена [1, с. 11]. Так что и её стоит поискать и выделить в виде тяжёлого льда.
Литература:
1. Петрянов И.В. Самое необыкновенное вещество в мире, М., 1975.
2. Синюков В.В. Вода известная и неизвестная, М., 1987.
3. Аджиев М. Осторожно, тяжёлая вода! // Наука и жизнь, №10, 1988 г.
4. Мухачёв В.М. "Живая" вода, М., 1975.
Дата установки: 11.02.2007




