

Так часто называют коррозию и особенно ржавление железа. Ежегодно этот коварный “недуг” уносит целые гекатомбы своих обладающих “стальной закалкой” жертв. Но, называя коррозию “болезнью”, в слово не вкладывают глубокого смысла – оно не более чем красивое образное сравнение. Металл не живое существо, а коррозия – не биологический процесс. И всё же коррозия, как никакая другая реакция, схожа с болезнями людей и продуктов.
Словно медики, металлурги борются с этой "хворью", "лечат" металл, вводя в него химические лекарства, ограждая защитными покрытиями от проникновения опасной “заразы”, и всё равно часто оказываются бессильны перед коррозией, как врачи перед иными болезнями. Обычно им остаётся лишь беспомощно наблюдать за постепенным угасанием металла, разве что немного продляя его жизнь и облегчая страдания. Несмотря на, казалось бы, хорошую изученность коррозии, она продолжает таить в себе ещё немало загадок. Почти никогда нельзя уверенно предугадать, как поведёт себя металл, какой именно вид коррозии, когда разовьётся на нём и с какой скоростью будет протекать
[1]. Этим коррозия в корне отличается от других химических реакций, в которых скорость и выход продуктов можно рассчитать с большой точностью, и напоминает именно болезнь – сложный биологический процесс.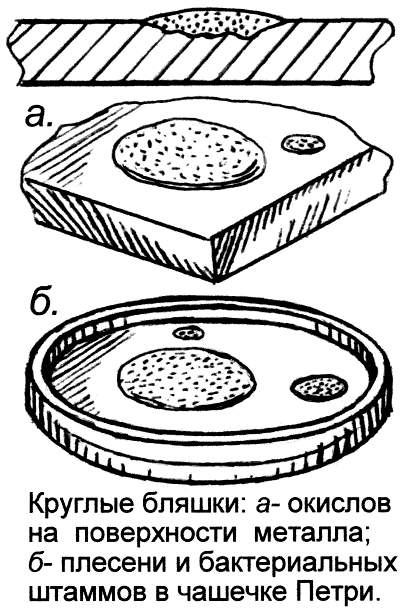
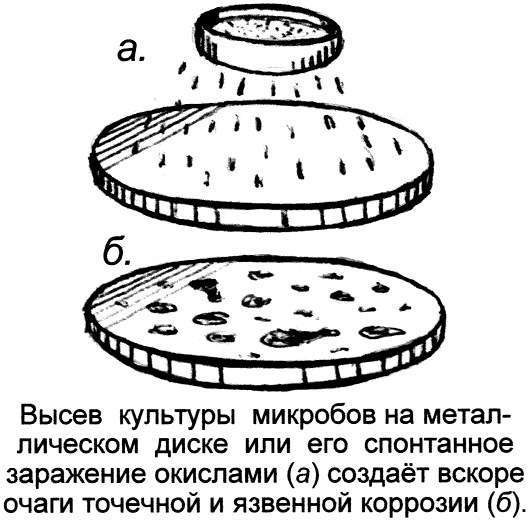
Вспомним обычную ржавчину. Она возникает внезапно, в виде безобидных крошечных очагов, бурых пятнышек, но, подобно эпидемии, очень быстро прогрессирует, распространяясь по металлу. Почему же металл не окисляется сразу по всей поверхности, а корродирует возле точечных очагов заражения его ржавчиной? Химики объяснят это тем, что ржавление – это автокаталитическая, самоподдерживающаяся реакция, в которой продукты коррозии сами же являются её катализаторами: крупинка ржавчины, попавшая на железо, служит зародышем всё убыстряющейся и самоподдерживающейся цепной реакции ржавления.
Но нельзя ли объяснить это цепное заражение металла тем, что ржавчину вызывает какой-то микроб, питающийся железом и добывающий энергию из его окисления? Ведь известно немало микроорганизмов, пищей которым служит не органика, но вещества неживой природы: сера, азот, водород, сурьма. Из таких микробов, питающихся энергией химических реакций окисления (ими же инициируемых), наиболее известны хемобактерии. Среди них были открыты и железобактерии, окисляющие железо. Так почему же не быть микробам, питающимся и другими металлами? Почему не предположить, что именно они и вызывают заражение металла, его болезнь – коррозию, распространяющуюся подобно эпидемии?
Так, если коррозия – это всего лишь реакция окисления, то почему она не идёт в сухом воздухе, где достаточно кислорода? Почему интенсивная коррозия протекает лишь при наличии влаги в воздухе или на поверхности металла? Химики объясняют это тем, что атмосферная коррозия – это электрохимическая реакция, влага же служит электролитом, ускоряющим такие процессы. Но с другой стороны влага необходима и для биопроцессов. Без воды нет жизни! В сухом воздухе все микробы погибают или входят в состояние анабиоза, спячки. Зато во влажном воздухе, особенно тропических лесов, бактерии и болезни расцветают. Так, может, потому же и металл заболевает коррозией именно во влажном воздухе?
Особенно сильно зависят от влаги грибы. Все знают, сколько грибов вырастает после дождика. Там, где сырость, обязательно разводится грибок – плесневый или какой похуже. Грибы – это одни из самых распространённых, неприхотливых и загадочных существ. Они живут всюду – под землёй, на деревьях, их споры носятся в воздухе. Они постоянно изменяются, мутируют, приспособляются. Грибок поражает не только растения, животных, продукты, но и стены деревянных, даже каменных зданий. С другой стороны, именно грибам мы обязаны такими жизненно важными продуктами как пенициллин, хлеб, пиво, самогон и т.п. Именно грибы чаще всего применяются в биохимических производствах. Микрогрибы, особенно почвенные, дрожжевые и плесневые, – это величайшие химики планеты. Поэтому, если какой-то микроорганизм и способен вызывать коррозию, это наверняка будет грибок.
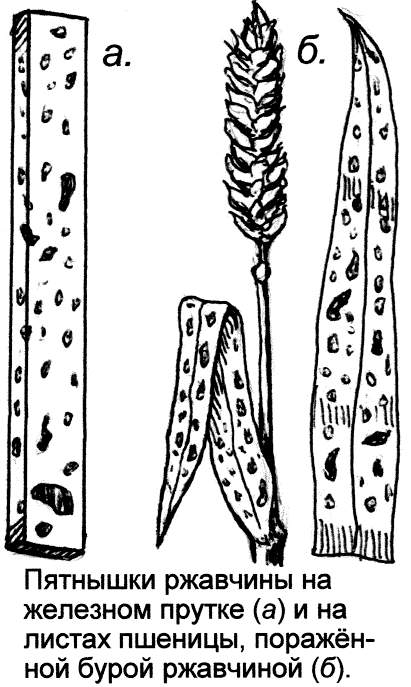
Сам характер поражения металла при коррозии, ржавлении более всего напоминает встречаемый на растениях, поражённых грибком. Тут и мучнистый налёт, круглые бляшки, очаги окислов, радиально разрастающиеся, словно мицелий гриба (вспомним круглые пятна плесени и грибные кольца в лесу), и шелушение, чешуйки ржавчины, рубцы, язвы, как у фитофторной картошки, и неровные наросты, наслоения. Эти структуры мало напоминают обычные формы выделения продуктов химических реакций, зато у них много общего с картиной поражённых грибком растений. Не зря вызываемый грибком рыжий тлетворный налёт на золотых колосьях пшеницы наши предки метко окрестили всё тем же страшным словом – "ржавчина". Видно, им-то хорошо была видна аналогия болезней железа и пшеницы.
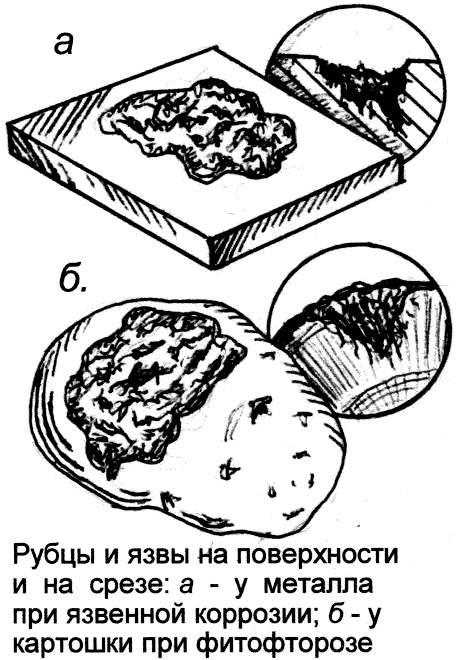
Подобно тому, как разные растения поражает свой вид грибка и своя форма грибковой болезни, каждый металл "болеет" своим видом коррозии. Некоторые же металлы к коррозии вообще невосприимчивы, иммунны – к примеру, алюминий, висмут, свинец, серебро, хром. Считают, что эти металлы ограждает от коррозии тонкая оксидная пассивирующая плёнка на их поверхности. Но, проще объяснить всё тем, что эти металлы несъедобны и даже ядовиты для грибка, вызывающего коррозию. Недаром препараты именно этих металлов применяют в медицине в качестве антисептиков. (Хотя, известны грибы, питающиеся алюминием, накапливающие в себе токсичные тяжёлые металлы и прочую гадость.) Иные же металлы от коррозии не спасает даже толстый слой краски – влага пробирается сквозь неё.
Кстати, о красках. Почему некоторые их виды легко устраняют коррозию, тогда как другие малоэффективны? Примером может служить всем известный сурик – краска на основе свинца, которая, покрывая днища кораблей, отлично защищает их от ржавчины. Дело, видно, именно в свинце, который для большинства живых существ токсичен. Свинец, присутствующий в сурике, и блокирует коррозию, убивая микробов.
Точно так же и некоторые другие краски не просто ограждают металл, но их пигменты и сами по себе ослабляют коррозию, являются её ингибиторами [1]. И неудивительно: давно замечено, что именно среди красителей особенно много веществ с бактерицидными, антисептическими свойствами.Кроме покраски существуют и другие меры борьбы с коррозией, в том числе упомянутые ингибиторы коррозии – вещества, тормозящие реакцию окисления металла. Среди них на первом месте, – что бы вы думали? – обычный формалин, известный всем как антисептик и фунгицид, препятствующий развитию грибка. И если химически объяснить такое свойство формалина сложно, то для биокоррозии – легко: формалин убивает грибок, одинаково защищая металл и кожаные вещи, причём независимо от вида коррозии и металла. Формалин должен губительно действовать на все грибы, блокируя любую коррозию. Антисептиками и консервантами на поверку оказываются и все прочие ингибиторы коррозии: соединения хрома (используемые для дубления кож), алкалоиды (среди которых много ядов), соли бензойной кислоты (известного антисептика, которым так богата клюква и брусника).
Но пусть сказанное не заставит читателя думать, что коррозия – это чисто биологический процесс. Нет, коррозия – это изначально процесс химического окисления металла. В чистом виде она создаёт окисные плёнки, интенсивно идёт в агрессивных средах, при контакте разнородных металлов, при наличии тока (электрокоррозия). Однако при низкой температуре и в нейтральной среде химическая коррозия идёт очень медленно. Роль же микробов в том и состоит, чтобы ускорить этот естественный процесс в тысячи, миллионы раз путём воздействия на реакцию особыми биологическими катализаторами – ферментами, или энзимами, чтобы использовать энергию процесса окисления. Так безобидная химическая коррозия при содействии микробов превращается в страшного пожирателя металлов.
Разницу между скоростью химического и биологического окисления каждый наблюдал на примере древесины. Дерево даже без нагревания постепенно "горит", окисляется на воздухе, но столь медленно, что потребовались бы тысячи лет, чтобы оно полностью истлело. Но стоит смочить дерево водой, или поместить его во влажную атмосферу, как оно, подобно металлу, в несколько лет окислится без остатка, сгниёт под воздействием микроорганизмов, селящихся во влажной древесине и ускоряющих гниение. Выделяя ферменты, эти микробы сообщают реакции небольшую, но необходимую для её протекания энергию активации, так сказать, вложенный капитал, который приносит им намного большую прибыль, когда запущенная реакция отдаёт энергию. Иногда это вызванное микробами энерговыделение бывает настолько мощным, что происходит самовозгорание гниющих веществ.
Интересно, что в учебниках химии в качестве примера таких изначально вялотекущих реакций медленного горения часто приводят как раз процессы образования ржавчины на железных предметах, усвоения пищи организмом, гниения, старения резин и масел
[2]. И, похоже, во всех этих примерах имеет место именно биологическое окисление, как в случае гниения и пищеварения, кстати, тоже протекающего при содействии микробов. Скажем, у процесса старения резины, становящейся от времени липкой или хрупкой, очень много общего с коррозией. Подобно ей, старение резины, раз начавшись в одной точке, словно болезнь, быстро распространяется во все стороны, передаваясь при контакте.Получается, и старение резин, каучука, латекса – это разложение под действием микробов, – вероятно уже не грибка, а бактерий. Недаром в качестве противостарительных добавок, вводимых в резину, применяют именно бактерицидные вещества – спирт и фенол (карболка), придающие свежей резине запах медкабинета и дёгтя. Микроорганизмы могут питаться как самим каучуком, так и сшивающими его молекулы атомами серы. Да и масло вряд ли прогоркает под влиянием одного лишь кислорода. Наверняка, и к этому процессу причастны микроорганизмы. Вполне возможно, что и пресловутые антиоксиданты, применяемые в борьбе с болезнями, старением материалов и людей, блокируют не само окисление и свободные радикалы, а жизнедеятельность микробов, поддерживающих это окисление.
Но вернёмся к болезням металла. Есть среди них одна такая, которая, казалось бы, никакого отношения к коррозии не имеет: роднит их только сходство "симптомов". Речь идёт об "оловянной чуме". Известно, что после морозов простое белое олово может начать превращаться в серый порошок – в серое олово, имеющее другую кристаллическую структуру. Этот процесс не зря назван "чумой": стоит на металл попасть хотя бы крупинке серого порошка, как "оловянная чума", словно эпидемия, мигом охватит весь металл. Здесь уже нет никакого окисления, но сам механизм "заражения" очень типичен для коррозии и болезней. Так что и здесь наши предки не ошиблись, назвав процесс "оловянной чумой", если она и впрямь вызвана болезнетворными для металла микробами, черпающими энергию из инициируемого ими распада, превращения олова. Об оловянной чуме и том, как с ней борются интересно рассказано в книге
[3]: “Учёные научились делать олову "прививки", обеспечивающие металлу иммунитет против "оловянной чумы". Подходящей для этой цели "вакциной" служит, например, висмут. Атомы висмута, поставляя дополнительные электроны в решётку олова, стабилизируют его состояние, что полностью исключает возможность "заболевания"”.Если "оловянную чуму" вызывают микробы, то кавычки здесь можно смело опустить, ибо это будет самая настоящая болезнь, а прививка висмутом будет оказывать именно биологическое, а не химически стабилизирующее действие. Тем более что висмут и его препараты известны как сильное антисептическое средство, убивающее микробов и способное в прямом смысле слова быть лекарством против оловянной чумы. Так же и легирование железа – введение в него примеси, например, хрома, – сильно ослабляет коррозию. Как и в случае висмута, "прививка" ядовитыми соединениями хрома должна уменьшать коррозию за счёт угнетения жизнедеятельности микробов. Но есть вещества микробам, напротив, необходимые. Поэтому "грязные" металлы менее коррозионостойки. Так, железо, загрязнённое серой, ржавеет очень быстро. Но такую коррозию, идущую в растворе, вызывают, вероятно, уже не грибы, а серобактерии, превращающие серу в серную кислоту, которая и разъедает металл. Именно так, с помощью кислоты, микробы часто и разрушают металл, камень, стены зданий.
Конечно, эти идеи слишком непривычны, чтобы их можно было принять на веру (хотя наука уже признаёт существование микробов, способствующих развитию коррозии). Поэтому нужны прямые опыты для их проверки. Можно, например, поместить кусок железа в колбу Пастера, наполненную водяным паром, и, прокалив её над огнём (дабы убить микробов), проверить спустя время – появится ли на железе ржавчина. Если её не будет, или будет совсем мало, это докажет, что в обычных условиях коррозию вызывают именно микроорганизмы. Их уничтожение либо совсем останавливает, либо сильно замедляет коррозию.
Ещё лучше попытаться непосредственно выявить среди окислов и ржавчины на поверхности металла возбудителей его болезни при помощи оптического или электронного микроскопа. Так что остаётся ждать нового Пастера, который откроет этих самых возбудителей и найдёт средство борьбы с ними, уменьшающее "смертность" металлических изделий. Пример Пастера весьма поучителен, поскольку до него учёные считали, что все болезни имеют химические причины, возникают от химической разладки организма. И лишь Пастер доказал, что большинство болезней имеет своего возбудителя, своего микроба (даже такие болезни как язва, рак, атеросклероз теперь связывают с вирусами и микробами). Интересно, что впервые он обнаружил возбудителей болезни не у живых существ, а именно у веществ, у сложных химических соединений – пива, вина, уксуса. И первыми возбудителями брожения и болезней, с которыми он столкнулся в бродильных чанах, оказались именно грибы – дрожжи и плесень. До Пастера брожение, порчу продуктов объясняли чисто химическими причинами, как ныне коррозию. Так что стоит задуматься о биологической природе болезней и у других созданных человеком веществ и материалов: металлов, резин, пластмасс.
Наш мир буквально пронизан микробами: они носятся в воздухе, в стратосфере, живут в земле, воде, они процветают и ведут активную жизнедеятельность даже в раскалённых кратерах вулканов, в ядерных реакторах, в холодных снегах Антарктиды. Они способны получать энергию из чего угодно – из тепла, света, из химических и было б не удивительно, если ещё и из ядерных реакций (см. например книгу В. Крупина "Карлики рождают гигантов"). Возможно, именно микроорганизмы создали природный ядерный реактор в Окло, накопив там радионуклиды. Не исключено, что микробы давно освоили и холодный ядерный синтез.
Роль микроорганизмов, как и до Пастера, всё ещё сильно недооценивается. Можно не сомневаться, что именно они сделали Землю такой, какая есть, что микробов надо рассматривать не только как разрушителей, но и как творцов. Ныне допускают, что даже погоду на Земле делают бактерии (см. "Инженер" 2005 №2, 2006 №4). И если микробы могут разрушать металл, то ещё более вероятно, что они же когда-то его создали в форме руды
[4]. Всё больше подтверждений находит гипотеза В.И. Вернадского о том, что залежи металлической руды, угля, нефти созданы микробами, переработавшими исходное сырьё и сконцентрировавшими его в месторождениях (так накапливают элементы и некоторые грибы, растения).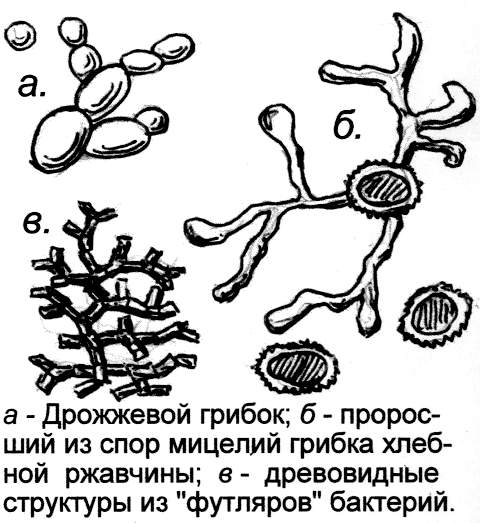
К примеру, есть веские основания считать, что огромные залежи железо-марганцовых конкреций, лежащие прямо на дне морском, созданы живущими в воде микробами
[3]. Подобные же микробы, вероятно, образуют на камнях налёт в виде бронзового "загара", содержащего много железа и марганца (некоторые железобактерии отлагают кроме железа соединения марганца). Многие могли видеть и плёнку ржавчины на болотах, созданную "футлярными" железобактериями. Отмирая, "футляры" железобактерий скапливаются на дне водоёмов в виде так называемой болотной руды. Древние болота могли быть гигантскими биохимическими реакторами, производящими ископаемые. Не зря вкрапления металла, самородки, их древовидные, как у кораллов, структуры производят впечатление чего-то, созданного живой природой. Так сказки про гномов, крошечных существ, собирающих подземные богатства и прячущих их в кладовых земли, могут оказаться правдой, если под этими крошечными существами понимать именно микроорганизмы [5]. По крайней мере, некоторые месторождения нефти, серы учёные уже всерьёз считают продуктами жизнедеятельности микробов.Современные сказки – научная фантастика, живописующая возможности микробов, – тоже фантастикой уже не кажется
[4]. Не раз в ней заходила речь о микробах, преобразующих голые безжизненные планеты, создающих почву, ландшафты и залежи полезных ископаемых, о микроорганизмах, жрущих пластик и металл. Тем и прекрасна настоящая сказка, что со временем высказанные там мысли могут обернуться реальностью. Заметим, что ещё первый научный фантаст, Жюль Верн, в романе "Дети капитана Гранта" подметил аналогию ржавчины и болезней, указав, что в Австралии, где природные условия мешают развитию микробов, мало болеют не только люди, но и металлы: железо на воздухе не ржавеет.Итак, если удастся выявить возбудителей болезни металла и других материалов, то не только сразу объяснятся все странности коррозии, но и откроются новые пути борьбы с ней в виде покрытий, "прививок", присадок, содержащих современные антисептики и антибиотики, способные подарить металлу "иммунитет" – коррозионную стойкость. Металлургу, разработчику сплавов предстоит тогда сделаться ещё и медиком, микробиологом, заняться лечением и профилактикой болезней металла. Быть может, тогда, наконец, удастся справиться с эпидемией, уносящей ежегодно миллионы тонн металла, с болезнью по имени коррозия. Но можно таких микробов поставить и на службу человеку, заставив их разрушать отходы, мусор, очищать стоки и воздух, добывать новые материалы, как уже нередко делают, правда, в ограниченных масштабах. К примеру, микробов уже используют в так называемой бактериальной гидрометаллургии для извлечения недоступного металла. Вывели даже бактерий, поглощающих из воды золото. Остаётся надеяться, что они послужат человечеству, а не любителям лёгкой наживы, страдающим "металлической болезнью" совсем иного рода.
С. Семиков
1. Кукушкин Ю.Н. Химия вокруг нас, – М., 1992.
2. Химия, пер. с нем., – М.: Химия, 1989.
3. Венецкий С.И. Рассказы о металлах, – М.: Металлургия, 1986.
4. Лысогоров Н.В. Когда отступает фантастика. – М., 1968.
5. Подольный Р. Невидимые творцы. – М., 1963.
Дата установки:
02.03.2008