

Не только физика атома, ядра, но и физика твёрдого тела, термодинамика и химия опираются теперь на квантовую механику. Неужели даже в этих, исконно классических науках нельзя объяснить явления наглядно, а нужен сложный аппарат квантовой механики? В физике ядра, атома и элементарных частиц, как оказалось, квантовые представления не только не обязательны, но часто просто ошибочны и уступают классическому описанию [1–4]. Да и в других разделах физики классический подход даёт естественное адекватное описание всех "квантовых" эффектов, стоит лишь правильно истолковать их, найти удачную механическую модель явлений, строения атомов и частиц. Такой моделью оказалась бипирамидальная магнитная модель атома. Её основы заложены Ритцем, Ленардом, Ленгмюром и Льюисом ещё в начале XX в. [5, 6]. По модели атом имеет форму двух пирамид, соединённых вершинами и послойно заполняемых электронами, что объясняет спектры атомов и законы фотоэффекта.
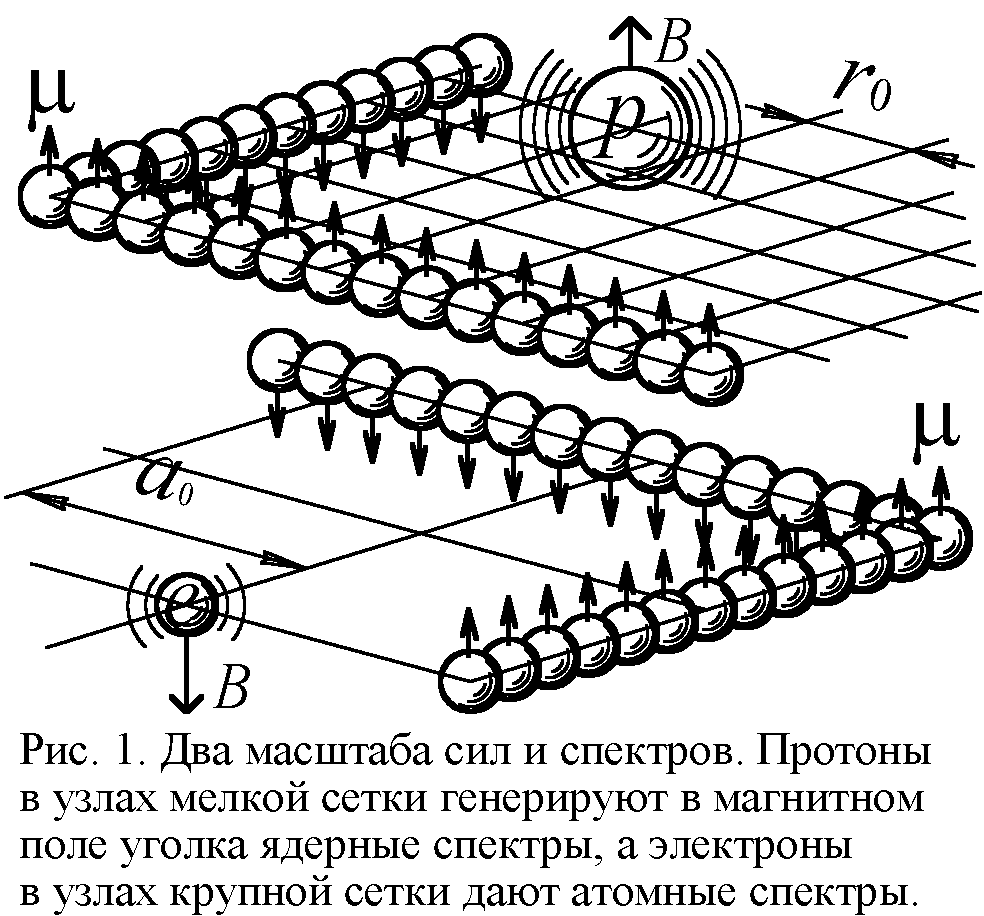
Так, спектр водорода даётся формулой Ритца: атом излучает дискретный набор частот f=Rc(1/n2–1/m2), где R – постоянная Ридберга, c – скорость света, n и m – целые числа. Из модели Ритца вытекает, что R=h/16π2ca2M, где a – период, шаг электрон-позитронной сетки атома (рис. 1), в узлах которой лежат генерирующие спектр заряды [1]. Постоянная Планка h связана с магнитным моментом электрона μ и его радиусом r0 как h=eμ0μ/r0. Реальную величину постоянной Ридберга даёт формула RH=e4M/8ε02h3c, где M – масса электрона. Из условия R=RH найдём значение a, с точностью до коэффициента 0,71 совпадающее с боровским радиусом атома водорода a0=ε0h2/πMe2=0,53·10–10 м. Итак, расстояния a между электронами в решётке порядка радиуса атома a0. Это естественно: раз атом сложен из электронных слоёв, включающих до 30-ти частиц, то и размеры его порядка межэлектронных отрезков (рис. 2).
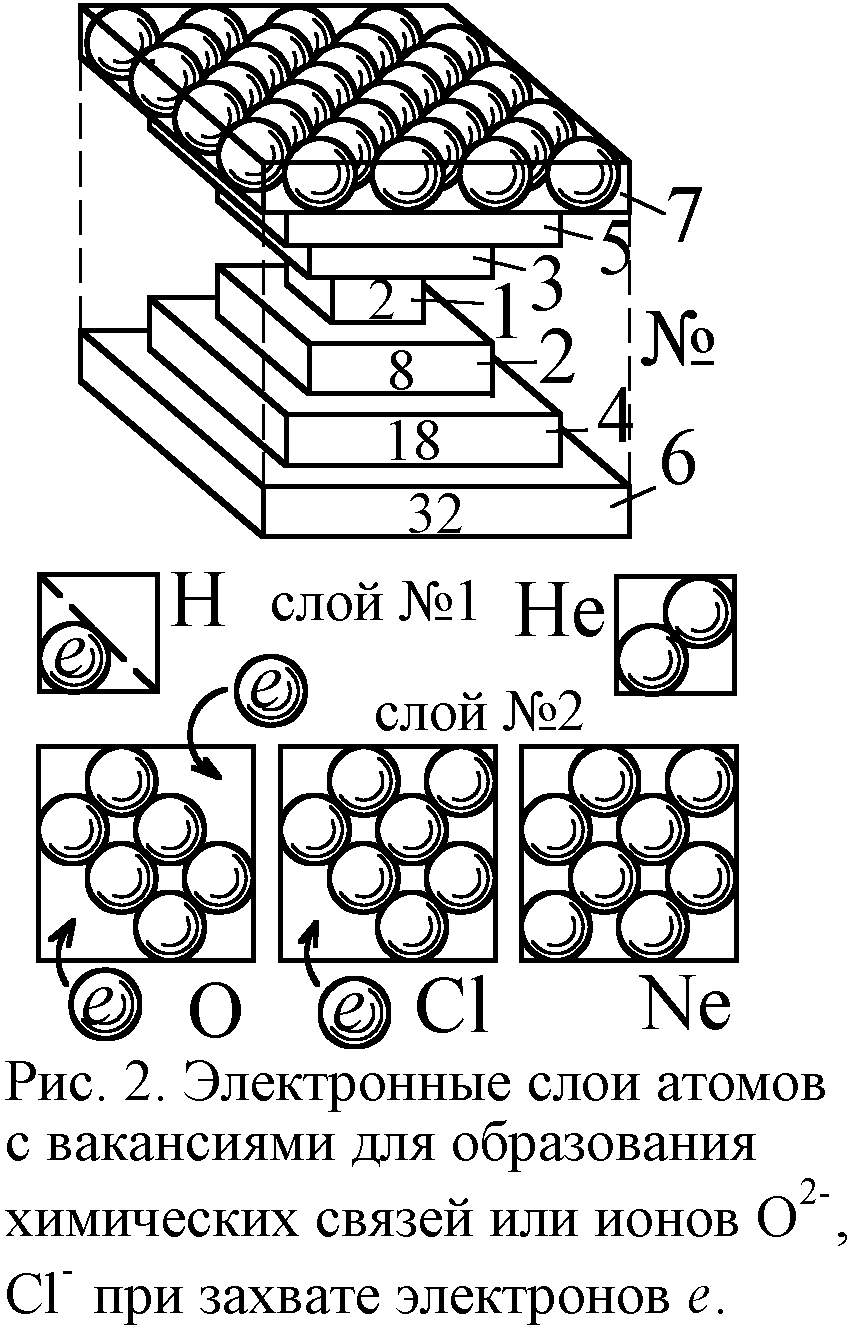
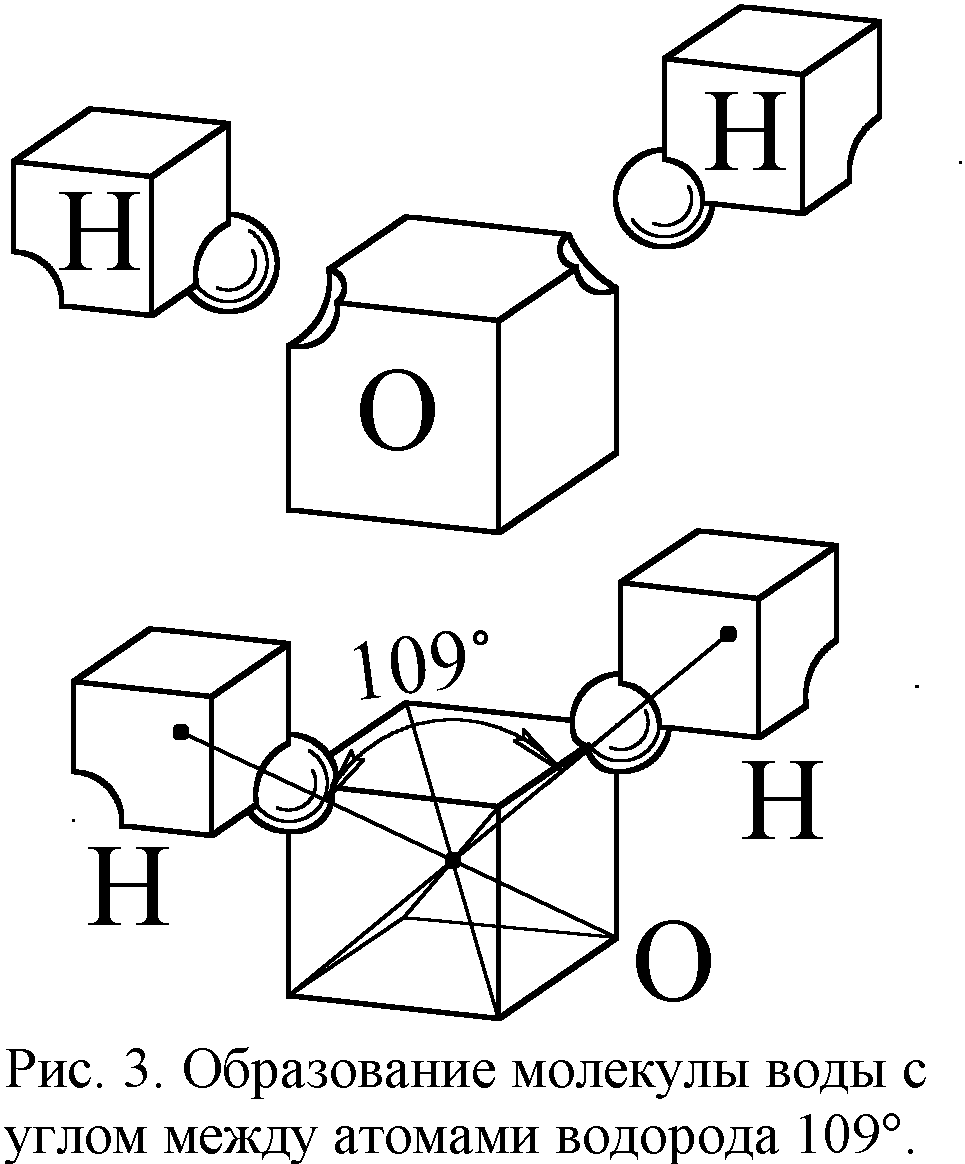
Размеры атомов и межэлектронные зазоры в слоях задают и межатомные расстояния в молекулах и кристаллах. Ведь ближе атомы сойтись не могут. Но почему же они не могут разойтись? Что удерживает атомы вместе в молекулах и кристаллах? Первое объяснение предложили те же Ленгмюр и Льюис на основе разработанной ими модели атома в форме куба [5, 6]. Эта модель соответствует бипирамидальной, поскольку бипирамида вписывается в куб (рис. 2). Модель Ленгмюра без всяких оснований отвергли, приняв квантовую теорию химической связи с абстрактными электронными облаками, орбиталями и их перекрытием. Зато в классической модели всё выглядело предельно просто. Электроны послойно заполняли пространственные уровни, оболочки атомов, и если в атоме уровень был заполнен не весь, его могли занять электроны других атомов, входящие в вакантное место, как ключ в замок. Например, атом кислорода имеет два свободных места на электронном уровне (рис. 2). Поэтому к нему могут пристыковаться два атома водорода, содержащие по одному электрону, и образуется молекула воды (рис. 3). Тогда угол между отрезками, соединяющими центры атомов, составит около 109° (угол меж диагоналями куба). Таков и реальный угол в 105-109°.
Это очень напоминает демокритову модель сцепления атомов. Демокрит считал, что на атомах есть выпуклости и впадины. Когда выпуклость одного атома попадает во впадину другого, они соединяются, как детали игрушечного конструктора [7]. Выпуклости – это электроны одного атома, а вогнутости, провалы – не занятые электронами места в слое другого. При этом силы, удерживающие атомы вместе, имеют электрическую природу. Те же силы удерживают в слое электроны – это силы притяжения к электрон-позитронной решётке [4].
Так же легко модель объясняет существование отрицательных ионов. В боровской же модели атом не в силах связать избыточный электрон, тем более несколько. А между тем есть много отрицательных ионов, скажем Cl–, O2–. По Бору нейтральный атом не удержал бы лишние электроны, но если учесть наличие вакансий в слое, то в них электрон-позитронная решётка вполне может связать и несколько электронов. В атоме хлора лишь одно свободное место (рис. 2). Поэтому атом захватывает один электрон и прочно его удерживает, образуя ион Cl–. В атоме кислорода слой имеет два незанятых места. Соответственно, по присоединении к ним электронов образуется ион O2–. Энергия связи электрона с атомом в этом случае называется сродством к электрону. Она того же порядка и той же природы, что энергия ионизации. Впрочем, если избыточных электронов чересчур много, отталкивание мешает их удержанию атомом. Атому, где больше свободных мест, чем занятых, проще отдавать электроны. Вот почему валентность атома – его способность образовывать химическую связь – определяется числом электронов, которые он может удержать или отдать. Эта первая и самая наглядная модель химической связи объясняет, как у атомов возникает данное число связей, почему энергия связи того же порядка, что и энергия ионизации (отрыва электрона). Квантовая же физика даёт невразумительные туманные объяснения, напоминающие мистические умствования противников Демокрита (Платона и Аристотеля) [7].
Подобный механизм связи атомов работает не только в молекулах, но и в аморфных твёрдых телах, жидкостях, где связи носят беспорядочный характер, то возникая, то разрываясь, отчего атомы соединяются без всякой системы. Другое дело – кристаллы. В них связи упорядочены и порядок этот, возможно, задан во многом правильным строением атомов и электронных слоёв. Оттого и соединение атомов происходит в геометрически точном стиле. Аналогично кирпичи, блоки с их правильной формой, укладываются в зданиях, пирамидах правильным образом. Давно открыто, что форма молекулярных кристаллов напрямую связана с формой молекул. Так же и кубическая, октаэдрическая (бипирамидальная) форма простых кристаллов, возможно, обусловлена такой же формой атомов. Итак, квантовая теория химической связи не только не обязательна, но и неестественна и даже не первична.
Атомы с их жёстким каркасом, скованные связями, обладают всё же некой свободой движений. Они могут отдаляться друг от друга. При этом на атомы действуют силы притяжения электронов одного атома к электрон-позитронной решётке другого. Могут атомы и сближаться, тогда их отталкивают силы упругости атомного каркаса. Поэтому есть определённое равновесное межатомное расстояние, есть сопротивление тел сжатию и растяжению, и есть хаотические тепловые колебания атомов возле положений равновесия. Полагали, что классически нельзя получить стабильных систем из положительных и отрицательных зарядов. На этот счёт есть специально доказанная теорема Ирншоу. Поэтому утверждают, что лишь квантовые неклассические законы обеспечивают стабильность атомов и вещества. И всё же стабильность этих систем объяснима классически, достаточно учесть неэлектрические силы и изменение характера кулоновского взаимодействия на малых расстояниях [8].
Если рассматривать электроны и позитроны как жёсткие заряженные шарики с радиусом равным классическому радиусу электрона r0, они вполне могут образовать стабильные комплексы – элементарные частицы и ядра. Притягиваемые заряды сближаются и образуют кристаллическую решётку, как в кристалле соли. Но дальнейшее сближение либо рождает силы отталкивания, либо слабеет кулоновское притяжение. Это и задаёт равновесное расстояние между частицами равное классическому радиусу r0, отчего их удобно считать жёсткими шариками. Нарушение кулоновского закона при сближении до r0 связано с механизмом электрического взаимодействия [8]. Электронные комплексы, как выяснили, могут иметь и другой характерный масштаб, отличный от r0 и куда более крупный, сопоставимый с радиусом атома a0. Ведь кроме электрических есть ещё магнитные силы взаимодействия электронов. Учёт этих сил и позволяет им образовать устойчивые электронные слои масштаба a0.
Сопротивление атомов или электронов сближению соответствует известному в квантовой механике принципу запрета Паули, по которому два электрона не могут занять одно состояние. В классике этот закон возникает не как формальное правило, но как естественное следствие наличия у частиц (электронов и позитронов) эффективного радиуса отталкивания, отчего те ведут себя как жёсткие шарики, не способные занять одну позицию в атоме. Если один электрон занял своё положение на электронном уровне, другой уже не сможет там очутиться. Для него не будет места, как нет места в занятой ячейке для яиц. Выходит, электрон-позитронная решётка, сетка имеет, подобно миллиметровке, два характерных масштаба с разницей в 104–105 раз. Один масштаб, с шагом решётки в 10–15 м (1 ферми), определяет характерные размеры ядер и элементарных частиц. Другой, с шагом в 10–10 м (1 ангстрем) задаёт типичные размеры атомов, длины связей в молекулах. Переход от крупного масштаба к мелкому происходит по достижении энергий достаточных для преодоления отталкивания.
Наличие двух масштабов расстояний между электронами и позитронами имеет много важных следствий. Подобие двух этих сеток объясняет аналогию химических и ядерных процессов. Механизмы распада или синтеза молекул и ядер, выделение и поглощение энергии в реакциях во многом сходны. Ведь в обоих случаях происходит соединение и распад кристаллических комплексов, сцепляемых электростатическими силами притяжения электрон-позитронной решётки. Различны лишь масштабы. И поскольку масштабы расстояний отличаются в 105 раз, соответственно различаются и величины сил, выделяемых энергий и энергий связи. Ведь энергия кулоновского взаимодействия зарядов пропорциональна 1/r. И точно, характерные энергии связи электронов в атоме и самих атомов, энергии единичных актов химических реакций составляют единицы электронвольт, а энергии связи ядер, нуклонов, энергии распадов измеряются мегаэлектронвольтами – то есть в 106 раз больше.
Подобие атомных и ядерных структур отражено и в спектрах. Выше рассмотрели атомные спектры, порождаемые колеблющимся электроном в возбуждённом атоме. При этом каждому атому отвечал свой особый линейчатый спектр – индивидуальный штрихкод атома. Но есть также ядерные спектры возбуждённых ядер. И атомные и ядерные спектры излучаются при колебаниях зарядов, но если в атоме это электроны, то в ядрах – протоны. Они тоже колеблются с жёстко заданными, индивидуальными для каждого типа ядер частотами в магнитном поле атомного остова (рис. 1). Как выяснили, постоянная Ридберга R=h/16π2ca2M. Поскольку заряды колеблются в одном и том же атомном остове, различие будет лишь в шаге a электрон-позитронной сетки и массе M генерирующего заряда. Раз в ядрах расстояния a меж электронами и позитронами в 104–105 раз меньше расстояний в электронных слоях, а масса M протона в 2000 раз больше электронной, то R для ядер выйдет в 105–106 раз больше.
Соответственно, характерные частоты f~R ядерных спектров в 105 раз выше атомных. И точно, ядерные спектры лежат в рентгеновском и гамма-диапазоне 1016–1019 Гц, тогда как атомные, лежащие в инфракрасном и оптическом диапазоне 1011–1015 Гц, имеют на 5 порядков меньшие частоты. Итак, схожая структура спектров в виде ряда дискретно меняющихся частот, характерных для данного ядра или атома, говорит о едином механизме их генерации: Разница лишь в масштабе сеток, между узлами которых смещается генерирующий заряд. И если атомные спектры дают ключ к разгадке строения атома, то ядерные – к строению ядер.
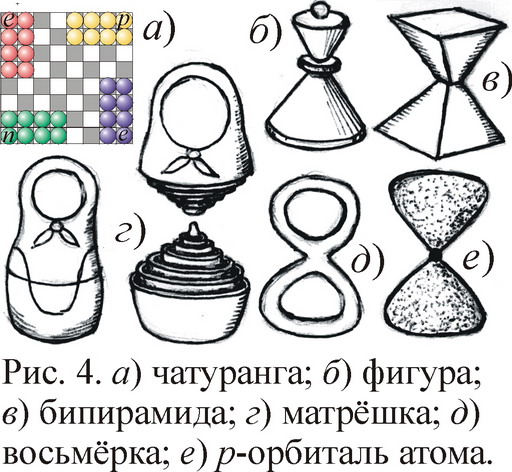
Единство атомных и ядерных свойств отражено, вероятно, и в древних играх. Вспомним сравнение электронов и позитронов с шахматными фигурами двух цветов, шагающими по шахматной доске электрон-позитронной сетки [2, 4]. Но есть ещё протоны с нейтронами, сидящие в той же сетке. Всего 4 типа частиц, фигур, четыре армии почти равной численности. И надо отметить, что в исконной древнеиндийской версии шахмат были фигуры как раз 4-х цветов, 4 армии, базируемых по углам шахматной доски, за которой играли четверо (рис. 4). Потому и назывались шахматы чатурангой. Отсюда снова просится мысль, что в схеме шахмат отражены забытые представления древних о структуре атома, всё ещё доходящие до нас в форме русской игры Рич-Рач, где фишки 4-х цветов ходят вдоль крестовины, как в модели Ритца [1]. Да и сами шахматные фигуры имеют биконическую, бипирамидальную форму атома. Другой пример подобия игр и строения атома даёт русская матрёшка – семь фигур-оболочек, вложенных одна в другую. Чем не модель атома, отражающая наличие семи электронных слоёв-оболочек? Вдобавок и матрёшки имеют форму восьмёрки, близкую к биконусу. Даже в квантовой физике эта восьмёрка-гантель возникла в виде p-орбитали атома [6].
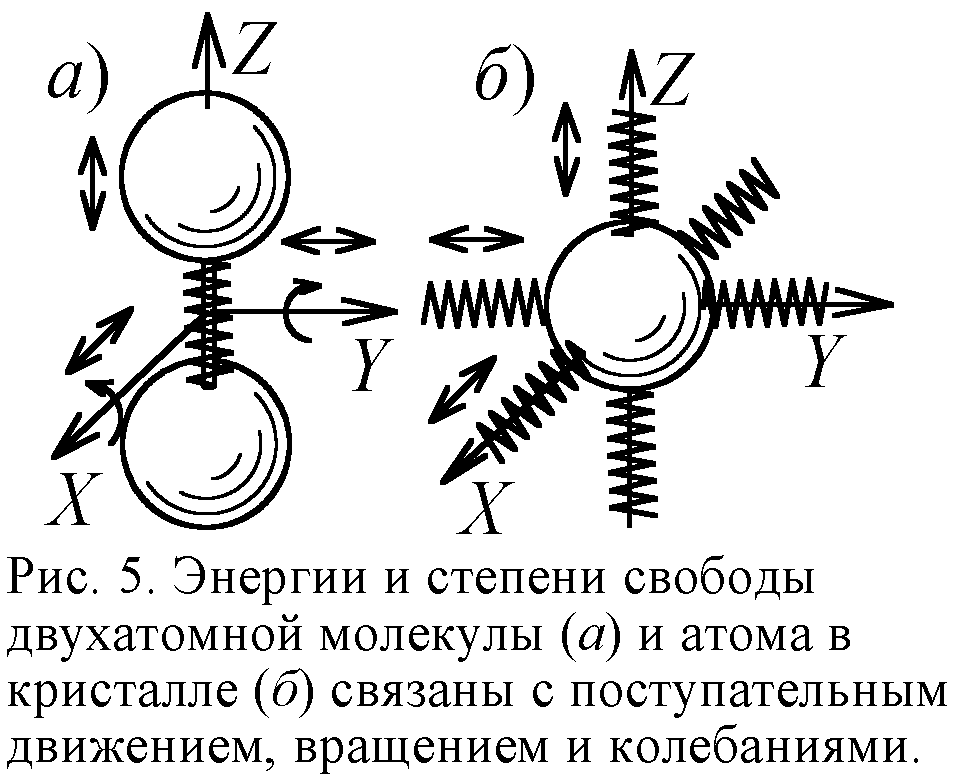
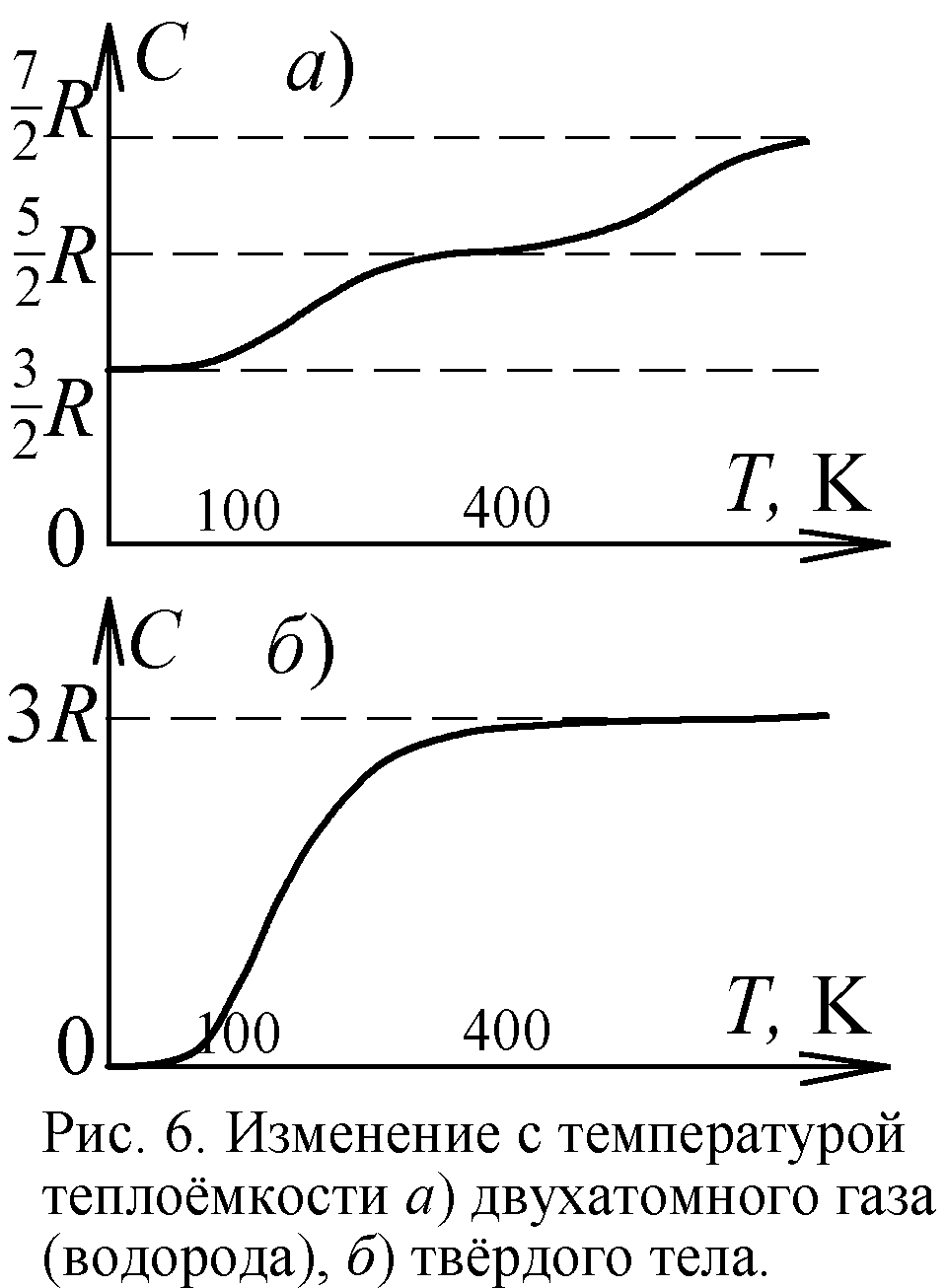
Ещё одним подтверждением квантовой теории в молекулярной физике считают явление вымерзания степеней свободы [5]. Известно, что двухатомная молекула, скажем, молекула водорода H2, обладает пятью степенями свободы. Три связаны с поступательным движением молекул вдоль трёх осей, и две – с вращением вокруг двух осей (рис. 5). На каждую степень свободы частицы приходится энергия kT/2, и двухатомная молекула обладает в среднем энергией 5kT/2, где k – постоянная Больцмана, T – температура. Одноатомная же молекула наделена лишь энергией поступательного движения 3kT/2. У двухатомных молекул реально есть и энергия упругих колебаний атомов. Поэтому энергия реальных двухатомных молекул 7kT/2. В итоге молярная теплоёмкость C (отношение внутренней энергии к температуре) газа из реальных двухатомных молекул есть 7R/2; из жёстких двухатомных – 5R/2; из одноатомных – 3R/2 (здесь R=kNa – газовая постоянная). И точно, при высоких температурах теплоёмкость водорода C=7R/2, однако при охлаждении C падает до 5R/2 (рис. 6). А с приближением к абсолютному нулю C стремится к 3R/2, словно у молекул газа при охлаждении "вымерзают" (сковываются) степени свободы. Двухатомные молекулы сначала становились жёсткими, а с дальнейшим охлаждением прекращали вращение, как одноатомные.
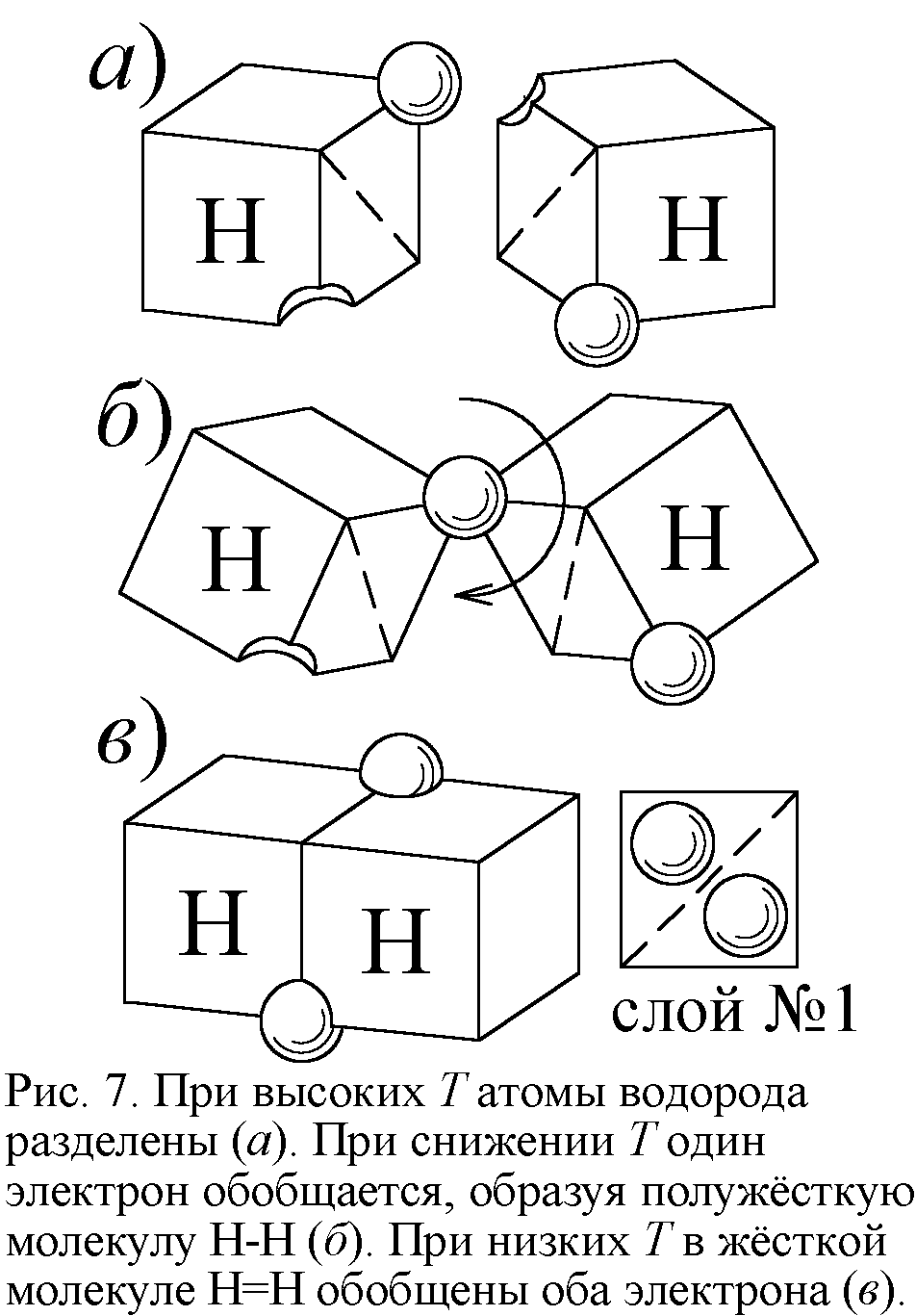
Такое уменьшение теплоёмкости двухатомных газов при понижении температуры, противоречащее классической молекулярно-кинетической теории теплоёмкости, нашло объяснение в квантовой теории. Долгое время казалось, что классическая физика не совместима с этим явлением. И всё же можно найти ему простое истолкование в традициях классики, стоит лишь принять модель атома Ритца. Тогда при высоких температурах атомы в полужёстких молекулах действительно колеблются, и C=7R/2. При снижении температуры энергии атомов уже не хватает для разрыва части связей и колебаний – молекула становится жёсткой. Атом водорода устроен таким образом, что в слое, где два места, электрон занимает лишь одно. Поэтому электрон второго атома водорода попадает в вакантное место, образуя химическую связь. А пустующее место второго атома заполняется электроном первого. Так возникает молекула водорода (рис. 7). При высоких T у большинства молекул водорода одна связь порвана. Молекула получается полужёсткой: её атомы могут вращаться, колебаться вокруг единственной точки связи. При спаде температуры энергии не хватает для разрыва связей, атомы полностью стыкуются, образуя двойную связь и жёсткую молекулу. Оттого и C=5R/2.
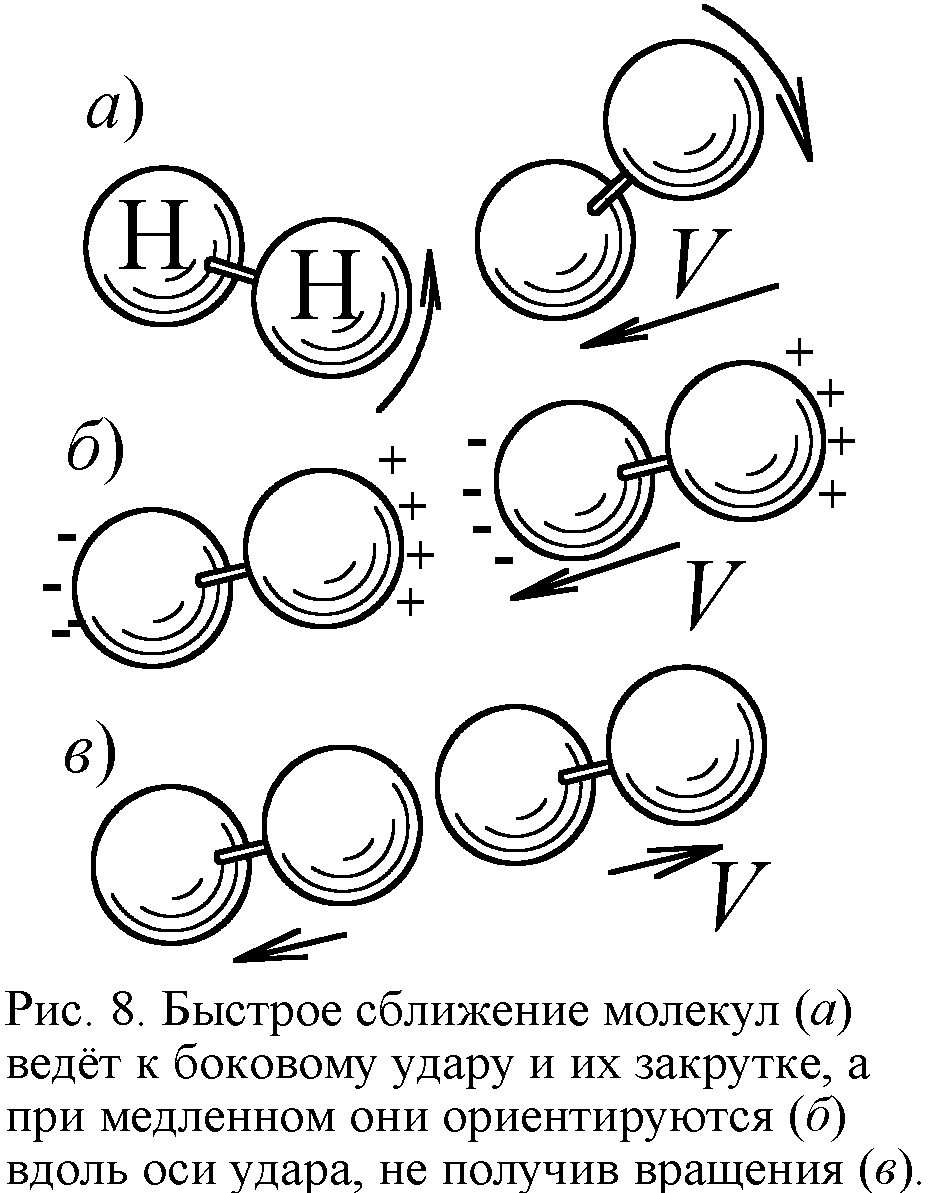
С дальнейшим охлаждением вымерзает и вращательная степень свободы: двухатомные молекулы перестают вращаться, что тоже вполне объяснимо. Молекулы получают вращение от косых, боковых соударений, когда часть кинетической энергии в ударе переходит в энергию вращения. Но с понижением температуры молекулы всё чаще испытывают прямые, лобовые соударения, и уже не закручиваются. Ведь при малой температуре частицы движутся медленно, отчего в процессе сближения электрические дипольные моменты молекул успевают сориентировать их перед ударом вдоль линии сближения. Вдоль они и отскакивают, не получив вращения (рис. 8). Так двухатомный газ при стремлении температуры к абсолютному нулю и теряет вращательные степени свободы, ведя себя как одноатомный с C=3R/2.
Как видим, явление не содержит ничего сверхъестественного и находит естественную классическую трактовку. Поэтому, обнаружив отклонения от классических законов, следует уточнять классическую модель, учтя неидеальность модели и приблизив её к реальности, а не отвергать сходу. Именно так Ван-дер-Ваальс для объяснения отклонений от молекулярно-кинетической теории (МКТ) предложил учесть в законе идеального газа конечный размер молекул и их взаимодействие, тем самым открыв точный закон [5]. А физики нового поколения наверняка поспешили бы отвергнуть классическую модель и вывести уравнение Ван-дер-Ваальса из квантовых законов. Итак, правильный путь развития физики пролегает через уточнение классических моделей, отход от идеализаций, работающих в узких рамках. Следуя путём Ван-дер-Ваальса, учтя взаимодействие атомов, их размеры, ограничивающие колебания, вращение, мы классически объяснили поведение теплоёмкости. Физики забыли путь Ван-дер-Ваальса и, сгоряча отвергнув классические модели, нагромоздили квантовых. Другой защитник МКТ, Больцман, доказавший эффективность классико-механического подхода, трагически умер в 1906 г. В период 1906–1909 гг., когда погибли активные защитники классики (Кюри, Друде, Больцман, Ритц), и пошло быстрое развитие неклассической физики.
Явление похожее на вымерзание степеней свободы обнаружилось и в твёрдых телах, кристаллах. Согласно МКТ и закону Дюлонга-Пти теплоёмкость твёрдых тел должна равняться 3R, поскольку каждый атом в твёрдом теле должен иметь энергию 3kT. Половина её приходится на энергию движения атома вдоль трёх осей, а половина – на энергию колебаний атома вдоль тех же трёх осей (рис. 5). Опыт показал справедливость закона Дюлонга-Пти в широком интервале температур. Однако с приближением температуры к абсолютному нулю теплоёмкость твёрдых тел падает до нуля, как от вымерзания степеней свободы (рис. 6). В рамках классической физики и МКТ это не удавалось понять. Лишь квантовая теория дала объяснение феномену. Оно было предложено Эйнштейном и уточнено Дебаем. Теория эта сложная, формальная и надуманная. Так, вместо классического максвелловского распределения молекул и атомов по скоростям вводятся распределения Ферми-Дирака, Бозе-Эйнштейна, фононы – возбуждения кристаллической решётки. Впрочем, истолковать классически этот эффект, полагали, вообще невозможно, И всё же приведём простое объяснение.
Повторяется ситуация с вымерзанием степеней свободы молекул газа, только в твёрдом теле при снижении температуры сковка атомов происходит в огромных масштабах. Всё больше атомов жёстко соединяются друг с другом, обретая новые связи и теряя свободу движений. При охлаждении в теле возникают всё более крупные жёсткие конгломераты из атомов – как бы гигантские жёсткие молекулы. С понижением T их становится всё меньше за счёт нарастания и слияния. А раз на каждую частицу, молекулу приходится энергия 3kT, то с уменьшением их числа полная энергия твёрдого тела и C падают. Наконец, при абсолютном нуле, когда всякое движение замирает, остаётся одна гигантская жёсткая молекула, включающая весь кристалл. Поэтому внутренняя энергия тела уже не 3kTNa, а 3kT (Na – число атомов тела молярного объёма). Эта энергия ничтожно мала, оттого и получаем C=0.
Итак, видим, что классическая молекулярно-кинетическая теория объясняет все особенности поведения твёрдых тел, газов, молекул, атомов и ядер. Слишком легко уступили учёные давлению модного квантового течения, даже не попробовав истолковать эффекты в рамках классической физики. Причина кризиса физики начала XX в. состояла не классической картине явлений, а в неудачных, неточных моделях. Большей частью эти модели страдали идеализацией, грубым упрощением. Они описывали предельный случай и не учитывали ряд атомных свойств и взаимодействий, важных при низких температурах. Если учесть все эти скрытые механизмы, любые явления удастся истолковать классическими моделями. Самая удачная из них – бипирамидально-сеточная кристалло-магнитная модель атома Ритца.
С. Семиков
1. Семиков С. Механизм атомного излучателя // Инженер, 2006 №10.
2. Семиков С. От Атома до Ядра // Инженер, 2007 №12.
3. Семиков С. Геометрия – ключ к микромиру // Инженер, 2008 №2.
4. Семиков С. Атомный кристалл–пирамида // Инженер, 2009 №3.
5. Блэквуд О. и др. Очерки по физике атома. М.–Л.: ОГИЗ, 1941.
6. Дмитриев И., Семёнов С. Квантовая химия, её прошлое и настоящее. М.: Атомиздат, 1980.
7. Рожанский И.Д. Античная наука. М.: Наука, 1980.
8. Семиков С. Масса и строение частиц // Инженер, 2006 №11.
Дата установки: 06.02.2010
[вернуться к содержанию сайта]
